Droga Experimental Restaura Equilíbrio Químico No Cérebro e Pode Transformar Tratamento Do TEPT
- Lidi Garcia
- 4 de ago.
- 5 min de leitura

Cientistas descobriram que pessoas com TEPT apresentam um desequilíbrio em uma substância chamada GABA no cérebro, causada por células chamadas astrócitos. Esse excesso de GABA dificulta a superação do medo e mantém os sintomas do transtorno. Um novo medicamento, o KDS2010, conseguiu restaurar esse equilíbrio em testes com animais e mostrou segurança em humanos, abrindo caminho para uma nova forma de tratar o TEPT de maneira mais eficaz.
O transtorno de estresse pós-traumático, conhecido como TEPT, é uma condição mental séria que pode surgir após uma pessoa viver uma experiência traumática intensa, como um acidente, abuso, guerra ou violência.
Pessoas com TEPT frequentemente enfrentam pensamentos perturbadores que surgem de forma inesperada, tentam evitar situações que lembram o trauma, sentem-se constantemente em estado de alerta e têm dificuldade para controlar suas emoções diante dessas lembranças. Mesmo com a gravidade do problema, os tratamentos disponíveis são limitados.
Atualmente, apenas dois medicamentos que agem sobre a serotonina, uma substância química do cérebro, são aprovados para tratar o TEPT. No entanto, esses remédios só funcionam completamente em cerca de 20 a 30% dos pacientes. Isso mostra claramente a necessidade urgente de desenvolver novas formas de tratamento mais eficazes.

Uma área do cérebro chamada córtex pré-frontal (CPF) tem um papel fundamental na maneira como lidamos com o medo e superamos experiências traumáticas.
Duas partes específicas dessa região, chamadas de regiões pré-límbica e infralímbica, ajudam a "apagar" ou reduzir a resposta de medo aprendida, o que é essencial para a recuperação após um trauma.
Em pessoas com TEPT, essa habilidade de "desligar" o medo parece estar comprometida. Além disso, o cérebro dessas pessoas mostra alterações em uma substância chamada GABA, que atua como um freio natural da atividade cerebral, ajudando a acalmar e controlar os sinais nervosos. Quando esse freio não funciona corretamente no córtex pré-frontal, o cérebro tem mais dificuldade de "desaprender" o medo, o que agrava os sintomas do TEPT.
Estudos com tecnologias avançadas, como a espectroscopia por ressonância magnética, indicam que há alterações nos níveis de GABA em pessoas com TEPT. Essas mudanças parecem afetar o fluxo sanguíneo no cérebro e contribuem para o problema.
Outro estudo com imagens cerebrais pós-morte confirmou que a função do GABA no cérebro de pessoas com TEPT estava desregulada. Especificamente, uma célula do cérebro chamada astrócito, que antes era considerada apenas uma "ajudante" dos neurônios, está produzindo GABA em excesso por meio de uma enzima chamada MAOB.

Em situações normais, os astrócitos regulam a produção de GABA para manter o equilíbrio, mas em condições de estresse ou doença, esses astrócitos se tornam "reativos", aumentando exageradamente essa produção e atrapalhando o funcionamento das sinapses (as conexões entre neurônios).
Essa produção excessiva de GABA por astrócitos já foi observada em outras doenças do cérebro, como Alzheimer, Parkinson e epilepsia, o que indica que esse pode ser um mecanismo comum de desregulação cerebral. No caso do TEPT, os pesquisadores suspeitam que esse GABA "tóxico" dificulta ainda mais a superação do medo e contribui para os sintomas persistentes do transtorno.
Para investigar essa hipótese, os cientistas realizaram um grande estudo com várias abordagens: examinaram pacientes com TEPT, analisaram cérebros humanos após a morte e também testaram modelos com camundongos que imitam o comportamento do TEPT.
Esses estudos confirmaram que os níveis de GABA estavam alterados na região pré-frontal do cérebro das pessoas com TEPT e que isso estava ligado à gravidade dos sintomas. Além disso, quando os cientistas bloquearam a enzima MAOB (responsável pela produção exagerada de GABA nos astrócitos), os sintomas de medo excessivo e dificuldade de "esquecer" o trauma foram aliviados nos camundongos.
Um medicamento chamado KDS2010, que inibe essa enzima de forma segura e seletiva, mostrou resultados animadores. Ele não só reduziu o GABA em excesso e melhorou o funcionamento do cérebro, como também passou com sucesso por testes iniciais em humanos (Fase 1), sem causar efeitos colaterais graves.
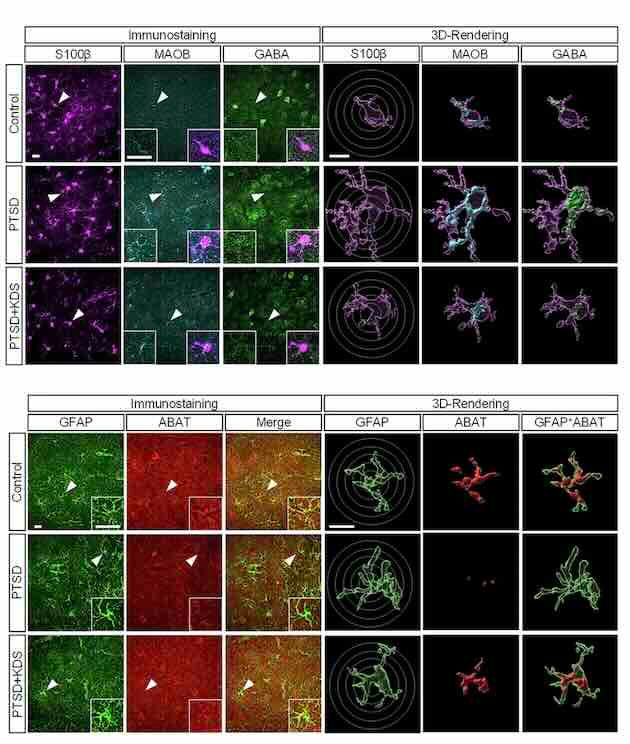
Estudo de modelo de camundongo controles e com TEPT com tratamento KDS2010. Essas imagens também comparam os três grupos: controle, TEPT e TEPT tratado com KDS2010. As imagens mostradas foram obtidas com microscopia confocal (uma técnica que permite visualizar estruturas muito pequenas dentro do cérebro com alta nitidez) e com o software Imaris, que ajuda a analisar essas imagens em 3D. Elas mostram a presença de três marcadores químicos: S100β, que identifica astrócitos (um tipo de célula do cérebro); MAOB, uma enzima que ajuda na produção de GABA; GABA, um neurotransmissor que inibe a atividade cerebral (e que está alterado no TEPT). GFAP, outro marcador de astrócitos, especialmente os que estão reativos (ou seja, ativados por algum tipo de dano ou estresse); ABAT, uma enzima que quebra o GABA e que também está envolvida no equilíbrio químico cerebral. O círculo marca uma análise chamada Sholl, que serve para medir a complexidade dos astrócitos, observando quantos “braços” ou ramificações eles têm, algo que muda quando essas células ficam "doentes" ou hiperativas.
Com isso, o KDS2010 se apresenta como uma nova e promissora opção de tratamento para o TEPT. Ele atua diretamente no mecanismo do problema, ou seja, no desequilíbrio do GABA causado por astrócitos reativos, e não apenas nos sintomas.

Traços representativos de correntes tônicas de GABA em todos os grupos.
Esse tipo de abordagem pode abrir caminho para tratamentos mais eficazes, oferecendo esperança para milhões de pessoas que convivem com esse transtorno debilitante.
Essa pesquisa representa um passo importante na busca por terapias baseadas em como o cérebro realmente funciona (mecanismos neurobiológicos), conectando estudos com humanos, experimentos em laboratório e desenvolvimento de medicamentos reais.
LEIA MAIS:
Astrocytic gamma-aminobutyric acid dysregulation as a therapeutic target for posttraumatic stress disorder
Sujung Yoon, Woojin Won, Suji Lee, Kayoung Han, Eunji Ha, Juheon Lee, Seung Jae Hyeon, Yoonji Joo, Haejin Hong, Hyangwon Lee, Yumi Song, Ki Duk Park, Bertrand R. Huber, Junghee Lee, Richard A. E. Edden, Minah Suh, Hoon Ryu, C. Justin Lee, and In Kyoon Lyoo
Signal Transduction and Targeted Therapy, 10, Article number: 240 (2025)
DOI: 10.1038/s41392-025-02317-5
Abstract:
Post-traumatic stress disorder (PTSD) remains a debilitating psychiatric condition with limited pharmacological treatment options. Identifying novel therapeutic targets is critical for addressing its unmet clinical needs. Through our comprehensive human clinical research, including both cross-sectional and longitudinal studies, we revealed a compelling link between dysregulated prefrontal gamma-aminobutyric acid (GABA) levels and PTSD symptoms. Notably, elevated prefrontal GABA levels in PTSD patients are associated with impaired cerebral blood flow (CBF) and symptom severity, normalizing with recovery, highlighting GABA dysregulation as a key mechanism in the disorder. Postmortem and PTSD-like mouse models implicated monoamine oxidase B (MAOB)-dependent astrocytic GABA as a primary driver of this imbalance, exacerbating deficit in fear extinction retrieval. Genetic and pharmacological inhibition of MAOB effectively restored astrocytic GABA and improved fear extinction retrieval in PTSD-like mouse models. Specifically, KDS2010, a recently developed highly selective and reversible MAOB inhibitor, not only restored astrocytic GABA homeostasis but also rescued CBF deficits and reduced tonic GABA and astrogliosis in the prefrontal cortex. Moreover, KDS2010 successfully advanced through Phase 1 clinical trials, showing a favorable safety profile and paving the way for Phase 2 trials to evaluate its therapeutic potential in PTSD. Our findings highlight the pivotal role of astrocytic GABA in PTSD pathophysiology and establish MAOB inhibition as a mechanistically targeted approach to alleviate symptoms. By bridging human and animal studies with translational clinical trials, this work positions KDS2010 as a promising first-in-class therapy, offering a novel paradigm for PTSD treatment.



Comentários