A Célula Artificial Mais Simples Já Criada Se Move Sozinha
- Lidi Garcia
- 29 de jul.
- 5 min de leitura

Cientistas criaram uma célula artificial super simples, feita de uma bolha com enzimas e um poro, que consegue se mover sozinha em direção a certas substâncias, como se tivesse um GPS químico. Essa descoberta mostra que até estruturas mínimas podem "navegar", ajudando a entender como as primeiras formas de vida podiam se mover e abrindo caminho para tecnologias como nanorrobôs que entregam medicamentos dentro do corpo.
As células são como pequenas fábricas vivas, complexas, organizadas e sempre em funcionamento. Tudo o que acontece dentro de nós depende dessas unidades minúsculas. Elas se movimentam, produzem energia, se reproduzem, transportam substâncias… é como se tivessem uma agenda lotada todos os dias.
Mas e se fosse possível construir uma célula artificial, algo que imita as funções básicas de uma célula real, mas com o mínimo possível de componentes?
Foi exatamente isso que um grupo de cientistas conseguiu fazer: eles criaram uma célula sintética extremamente simples que consegue até “navegar” em resposta a substâncias químicas no ambiente, um comportamento conhecido como quimiotaxia.
A quimiotaxia é essencial para muitas formas de vida. Pense em uma bactéria procurando comida ou em um glóbulo branco indo até um machucado para combater infecções. Essa movimentação ocorre porque essas células "sentem" sinais químicos e seguem em direção a eles.

O mais surpreendente é que os pesquisadores mostraram que mesmo uma estrutura mínima, uma simples bolha com algumas proteínas e enzimas, consegue fazer isso. Essa célula artificial não tem motor, cérebro ou flagelos, mas ainda assim “sabe” para onde ir.
Os cientistas, liderados pelo Instituto de Bioengenharia da Catalunha (IBEC), construíram essas células artificiais usando vesículas lipídicas, que são como bolhas microscópicas feitas de gordura (parecidas com a membrana das células reais).

Giuseppe Battaglia (à esquerda) e Bárbara Borges (à direita) no Instituto de Bioengenharia da Catalunha (IBEC).
Dentro delas, colocaram enzimas como glicose oxidase ou urease, que são capazes de transformar glicose ou ureia em outras substâncias. Para que essas bolhas conseguissem interagir com o ambiente, os pesquisadores adicionaram uma proteína chamada α-hemolisina, que forma um poro na membrana. Esse poro funciona como uma porta: permite a entrada e saída de moléculas.
A sacada genial está na assimetria. Como as enzimas estão confinadas e os poros estão em locais específicos, as reações químicas não acontecem de maneira uniforme em toda a superfície da vesícula. Esse pequeno desequilíbrio cria um fluxo ao redor da bolha que a empurra em uma direção, justamente em direção à maior concentração da substância que ela reconhece. É como se a célula “sentisse” onde tem mais comida e fosse até lá.
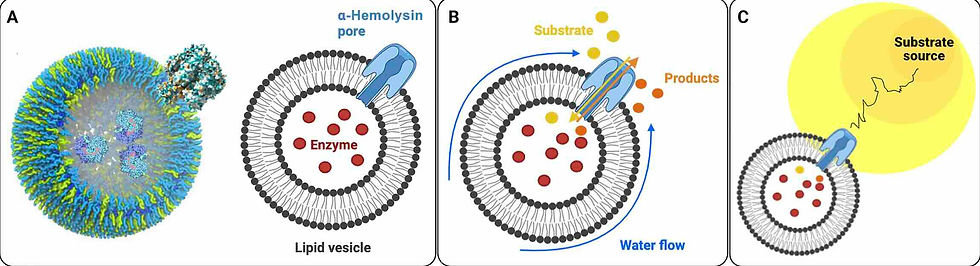
Representação esquemática de uma célula quimiotática mínima. (A) Vesículas lipídicas formam um compartimento usado para encapsular enzimas. A proteína Hly, responsável pela toxina, cria poros dentro da membrana lipídica, gerando uma assimetria. (B) Moléculas de substrato reagem com as enzimas após a imersão das vesículas encapsuladoras de enzimas em um gradiente de substrato. O substrato é então convertido em moléculas de produto que se difundem preferencialmente para fora através do poro, gerando um gradiente localizado de concentração de produto. Este gradiente de produto, por sua vez, induz o fluxo de fluido ao longo da superfície da vesícula. (C) A velocidade de deslizamento do fluido na membrana da vesícula a coloca em movimento de recuo alinhado com a direção do gradiente de concentração do substrato. O tamanho relativo do poro em relação à espessura da membrana não está em escala.
A equipe testou esse sistema em laboratório, dentro de canais microscópicos, e acompanhou o movimento dessas células artificiais usando microscopia com fluorescência.
Elas seguiram o rastro químico criado com glicose ou ureia, e o efeito foi ainda mais evidente quando as vesículas tinham mais poros. Ou seja, quanto mais “portas” elas tinham, mais sensíveis ficavam ao ambiente, e melhor se moviam em direção ao que estavam “procurando”.
Essa descoberta é mais do que uma curiosidade científica. Ela nos ajuda a entender como os primeiros sistemas vivos do planeta podem ter se movimentado, muito antes de desenvolverem estruturas complexas como flagelos ou músculos. Também abre caminho para tecnologias futuras, como nanorrobôs que navegam dentro do corpo humano para entregar medicamentos em locais precisos.

Porificação das vesículas com Hly. (A e B) Imagens de microscopia eletrônica de transmissão (TEM) mostram vesículas (pequenas bolhas que imitam células) que foram incubadas com a proteína Hly. As setas pretas indicam proteínas Hly que não se ligaram às vesículas, enquanto as setas vermelhas mostram onde a Hly conseguiu se inserir na membrana das vesículas, formando pequenos poros. A barra de escala representa 50 nanômetros (nm), uma medida extremamente pequena. (C) Outras imagens TEM mostram a proteína Hly livre após a incubação com as vesículas. Uma área ampliada mostra o perfil da intensidade dos pixels, ou seja, a variação da imagem em uma linha tracejada que destaca a proteína. As setas vermelhas indicam o tamanho do poro (~4 nm, linha tracejada) e da parte externa da proteína que lembra um "chapéu de cogumelo" (~10 nm, linha contínua). A escala aqui é de 10 nm. (D) Imagens de criomicroscopia eletrônica (ou seja, com amostras congeladas) mostram vesículas com mais proteína Hly (proporção Hly/PC = 0,5), indicando com mais clareza a presença de poros. A escala é de 50 nm. (E) Um teste foi feito para medir a permeabilidade (ou seja, quão bem os poros funcionam) das vesículas com diferentes quantidades de Hly. Para isso, usaram um corante fluorescente que muda de intensidade quando interage com o cálcio dentro das vesículas. O gráfico mostra a razão de fluorescência (F395/F495) medida com luz ultravioleta (340 nm) conforme a quantidade de Hly aumentava, ou seja, mais Hly, mais passagem de substâncias.
Como disse o professor Lorenzo Battaglia, líder da pesquisa: “Construa de forma simples, compreenda profundamente”. Ao reduzir a célula ao mínimo, uma bolha, uma enzima e um poro, os cientistas revelaram um dos mecanismos mais fundamentais da vida: como as células sabem para onde ir. E isso, no fim das contas, nos ajuda a entender melhor não só o que somos, mas de onde viemos.
LEIA MAIS:
The minimal chemotactic cell
BÁRBARA BORGES-FERNANDES, AZZURRA APRICENO, ANDRES ARANGO-RESTREPO, SAFA ALMADHI, SUBHADIP GHOSH, JOE FORTH, JORGE PEDRO LÓPEZ-ALONSO, IBAN UBARRETXENA-BELANDIA, JOSÉ MIGUEL RUBI, LORENA RUIZ-PÉREZ, IAN WILLIAMS, AND GIUSEPPE BATTAGLIA
SCIENCE ADVANCES, 25 Jul 2025, Vol 11, Issue 30
DOI: 10.1126/sciadv.adx9364
Abstract:
The movement of cells and microorganisms in response to chemical gradients, chemotaxis, is fundamental to the evolution of myriad biological processes. In this work, we demonstrate that even the simplest cell-like structures are capable of chemotactic navigation. By encapsulating enzymes within lipid vesicles that incorporate a minimal number of membrane pores, we reveal that a solitary vesicle can actively propel itself toward an enzyme substrate gradient. Specifically, vesicles loaded with either glucose oxidase or urease and embedded with corresponding transmembrane proteins were tracked within a microfluidic device under a controlled substrate gradient. Our findings establish that a system comprising only an encapsulated enzyme and a single transmembrane pore is sufficient to initiate chemotaxis. This proof-of-concept model underscores the minimalistic yet powerful nature of cellular navigation mechanisms, providing a previously unknown perspective on the origins and evolution of chemotactic behavior in biological systems.



Comentários